Атомы элементов одной группы имеют одинаковое строение внешней электронной оболочки. Именно поэтому такие элементы имеют сходные химические свойства.
Атомы элементов одного периода имеют одинаковое число энергетических уровней.
Периодический закон: «свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома».
Закономерности изменения свойств элементов по группам и периодам:
Увеличивается: заряд, ЭО, окислительные свойства, неметаллические свойства.
Уменьшается: радиус, восстановительные свойства, металлические свойства.
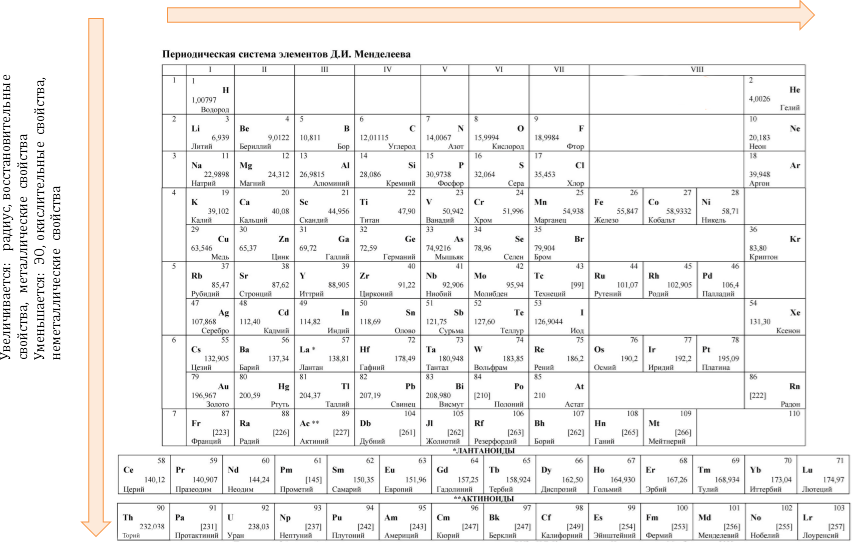
Изменение некоторых характеристик элементов в периодах слева направо:
- заряд ядер атомов увеличивается,
- радиус атомов уменьшается, потому-что происходит сжатие. Ядру требуется больше энергии, чтобы удержать большое количество электронов, на внешнем уровне,
- электроотрицательность элементов увеличивается. (Самый электроотрицательный эелемент – F),
- количество валентных электронов увеличивается от 1 до 8 (равно номеру группы),
- высшая степень окисления увеличивается (равна номеру группы),
- число электронных слоев атомов постоянно, так как это число равно номеру периода,
- металлические свойства уменьшаются, так как к концу периода распалагаются неметаллы,
- неметаллические элементов увеличивается.
(Неметалличность – это способность атомов элемента присоединять электроны). Изменение некоторых характеристик элементов в группе сверху вниз:
- заряд ядер атомов увеличивается,
- радиус атомов увеличивается, потому что увеличивается число электронных слоев,
- число энергетических уровней (электронных слоев) атомов увеличивается (равно номеру периода),
- число электронов на внешнем слое атомов одинаково (равно номеру группы),
- прочность связи электронов внешнего слоя с ядром уменьшается,
- электроотрицательность уменьшается,
- металличность элементов увеличивается, так как самый типичный металл — это Fr. (Металличность – это способность элемента отдавать электроны),
- неметалличность элементов уменьшается.
Элементы, которые находятся в одной подгруппе, являются элементами-аналогами, т. к. они имеют некоторые общие свойства (одинаковую высшую валентность, одинаковые формы оксидов и гидроксидов и др.). Эти общие свойства объясняются строением внешнего электронного слоя.
Электроотрицательностью элемента характеризуется способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.