Степень окисления ― это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна. В этом материале мы рассмотрим степень окисления и валентность химических элементов.
Расчет степени окисления
Существуют следующие правила для определения степеней окисления (СО):
- CO любого элемента в простом веществе (Н2, Al, S) равна 0.
- Сумма всех CO атомов в молекуле равна 0.
- Наиболее электроотрицательные элементы в соединении имеют отрицательные CO, а атомы элементов с меньшей электроотрицательностью ― положительные.
Например, азот более электроотрицательный, чем водород, поэтому он имеет заряд –3, а водород +1. В молекуле три атома водорода, каждый дает заряд +1, а в сумме +3, молекула сама нейтральна, заряд = 0.
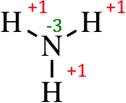
Максимальная CO любого элемента равна номеру группы (исключения: медь, серебро, золото, фтор, кислород), а минимальная отрицательная равна N – 8, где N ― номер группы.
Некоторые элементы имеют постоянные CO, их нужно знать, они помогут вычислить СО других элементов, имеющих несколько значений СО.
- щелочных металлов +1,
- Mg, Be и щелочноземельных металлов +2,
- алюминия +3,
- фтора –1,
- водорода +1 (кроме гидридов NaH, CaH2 и др., где степень окисления водорода ―1),
- кислорода –2 (кроме OF2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода ―1).
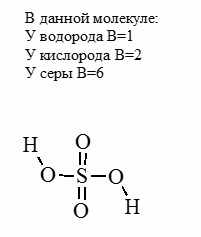
Пример расчета степеней окисления в сложной молекуле (серная кислота):
Изображаем структурную формулу молекулы, черточка ― это связь, пара электронов.
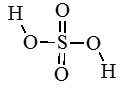
Из черточки рисуем стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть ― нет перехода электронов.
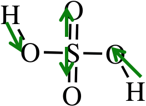
У кислорода и водорода известные степени окисления: у кислорода -2, у водорода +1. Степень окисления серы принимаем за X.
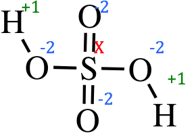
Составляем уравнение (складываем все степени окисления и приравниваем к 0, так как молекула является нейтральной)
+1 + (+1) + (-2) + (-2) + (-2) + (-2) + Х = 0
X = +6
Валентность что это?
Валентность ― способность атомов образовывать определенное количество связей с другими атомами.
Валентные возможности атомов определяются:
- числом неспаренных электронов (одноэлектронных орбиталей),
- наличием свободных орбиталей,
- наличием неподеленных пар электронов.
Если нарисовать структурную формулу и посчитать количество черточек (связей) мы узнаем валентность.
Для примера разберем молекулу серной кислоты:
Взаимосвязь между высшей валентностью элемента и числом неспаренных электронов.
| № группы | I | II | III | IV | V | VI | VII | I | II | III | IV | V | VI | VII |
| Элементы | Li | Be | B | C | N | O | F | Na | Mg | Al | Si | P | S | Cl |
| Число неспаренных электронов в основном состоянии | 1 | 0 | 1 | 2 | 3 | 2 | 1 | 1 | 0 | 1 | 2 | 3 | 2 | 1 |
| Число неспаренных электронов в возбужденном состоянии | 2 | 3 | 4 | 2 | 3 | 4 | 5 | 4 6 | 3 5 7 | |||||
| Высшая валентность | I | II | III | IV | III | II | I | I | II | III | IV | V | IV | VII |
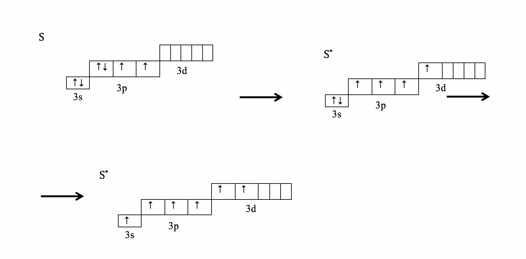
Рассмотрим атом серы, какие валентности он может иметь.
Для атома серы переход в возбужденное состояние возможен. В процессе возбуждения электроны атома серы переходят с 3s- и 3p-подуровней на свободные орбитали 3d-подуровня:
Примеры ЕГЭ на расчет степени окисления и валентность
Задание 1.
Ряд элементов: 1) Na 2) Cl 3) Si 4) Mn 5) Cr
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять валентность I.
Ответ: 12
Решение: Na – находится в первой группе, значит он может проявлять валентность только 1, а Cl находится в VII группе, то он может проявлять различные валентности, но самое главное, что в соединении HCl он проявляет валентность равную I.
Задание 2.
Ряд элементов: 1) Al 2)S 3)Cr 4)P 5)Si
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в высших оксидах равна +6. Запишите в поле ответа номера выбранных элементов.
Ответ: 23
Решение: Нам нужно найти те элементы, которые находятся в VI группе – это сера и хром, именно их мы и выбираем.
Задание 3.
Ряд элементов: 1) Al 2) Si 3)Mg 4) C 5) N
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления. Запишите в поле ответа номера выбранных элементов.
Ответ: 13
Решение: Что значит найти постоянную степень окисления? Это значит то, что вещество должно проявлять только одну степень окисления. Например алюминий всегда проявляет степень окисления +3, а магний только +2.
Задание 4.
Ряд элементов: 1) B 2) Al 3) F 4) Fe 5) N
Из числа указанных в ряду элементов выберите два элемента, которые проявляют в оксидах степень окисления как +2, так и +3. Запишите в поле ответа номера выбранных элементов.
Ответ: 45
Решение: Мы видим степени окисления +2 и +3, это однозначно железо, потому что у него есть оксиды: FeO и Fe2O3. Азот может принимать любую степень окисления от -3 до +5, поэтому этот вариант нам тоже подходит. NO и N2O3
Задание 5.
Ряд элементов: 1) S 2) Na 3) Al 4) Si 5) Mg
Из числа указанных в ряду элементов выберите два элемента, которые в соединении с кислородом проявляют степень окисления +4.
Ответ: 14
Решение: Соединения с кислородом в степени окисления +4 имеют общий вид: ЭO2. Есть такой оксид, как SiO2 и SO2, значит эти элементы могут проявлять степень окисления +4 с кислородом.