Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется между атомами неметаллов.
Электроотрицательность неметаллов довольно велика, так что при химическом взаимодействии двух атомов неметаллов полный перенос электронов от одного к другому (как в случае ионной связи) невозможен. В этом случае для выполнения правила октета необходимо объединение электронов.
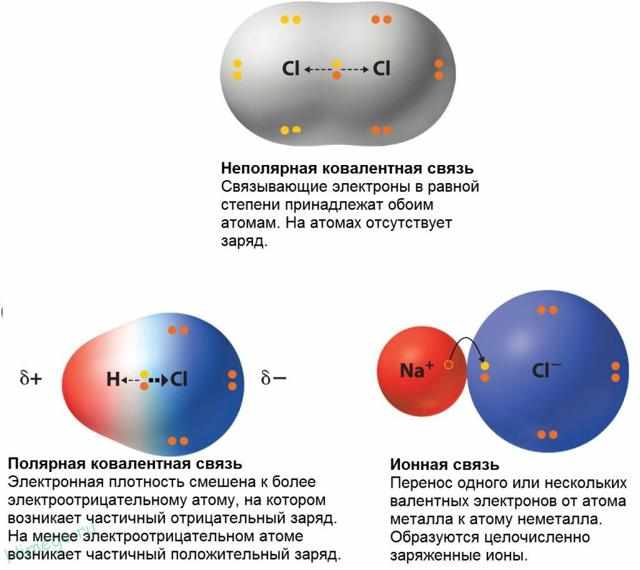
- Неполярная ковалентная связь
- Полярная ковалентная связь
- Обменный и донорно-акцепторный механизм образования ковалентной связи
- Ковалентная связь – полярная и неполярная: что это такое и какова формула вещества
- Свойства
- Полярность
- Механизм образования
- Обменный
- Донорно-акцепторный
- Гибридизация
- Вывод
- Ковалентная связь: полярная, неполярная, механизмы ее появления
- Ковалентная связь – определение, характеристика. Что такое ковалентная связь?
- Типы ковалентной связи
- Ковалентная неполярная связь
- Ковалентная полярная связь
- Как определить ковалентную связь
- Свойства и строение вещества: ковалентная неполярная связь, отличие от полярной
- Физика или химия?
- Электронные уровни
- Образование ковалентной связи
- Свойства ковалентных связей
- Вода, кристалл, плазма
- Ковалентные неполярные и полярные связи
- Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая
- Типы химической связи
- Ковалентная полярная и неполярная химическая связь: примеры, донорно-акцепторный механизм образований
- Что это
- Структура с «полюсами»
- Как появляется
- О неполярной структуре
- Как появляется
- Что такое ковалентная полярная связь
Неполярная ковалентная связь
В качестве примера обсудим взаимодействие атомов водорода и хлора:
- H 1s1 — один электрон
- Cl 1s2 2s2 2p6 3s2 3p5 — семь электронов на внешнем уровне
Каждому из двух атомов недостает по одному электрону для того, чтобы иметь завершенную внешнюю электронную оболочку. И каждый из атомов выделяет „в общее пользование” по одному электрону. Тем самым правило октета оказывается выполненным. :
Образование ковалентной связи
Обобществленные электроны принадлежат теперь обоим атомам. Атом водорода имеет два электрона (свой собственный и обобществленный электрон атома хлора), а атом хлора — восемь электронов (свои плюс обобществленный электрон атома водорода).
Эти два обобществленных электрона образуют ковалентную связь между атомами водорода и хлора. Образовавшаяся при связывании двух атомов частица называется молекулой.
Образование ковалентной неполярной связи
Благодаря спариванию и обобществлению двух электронов удается выполнить правило октета для обоих атомов.
Помимо одинарных связей может образовываться двойная или тройная ковалентная связь, как, например, в молекулах кислорода О2 или азота N2. Атомы азота имеют по пять валентных электронов, следовательно, для завершения оболочки требуется еще по три электрона. Это достигается обобществлением трех пар электронов.
Ковалентные соединения — обычно газы, жидкости или сравнительно низкоплавкие твердые вещества. Одним из редких исключений является алмаз, который плавится выше 3 500 °С.
Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул.
Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу.
Ковалентная связь возникает при объединении электронов двух атомов неметаллов. Возникшая при этом структура называется молекулой.
Полярная ковалентная связь
В большинстве случаев два ковалентно связанных атома имеют разную электроотрицательность и обобществленные электроны не принадлежат двум атомам в равной степени. Большую часть времени они находятся ближе к одному атому, чем к другому.
В молекуле хлороводорода, например, электроны, образующие ковалентную связь, располагаются ближе к атому хлора, поскольку его электроотрицательность выше, чем у водорода. Однако разница в способности притягивать электроны не столь велика, чтобы произошел полный перенос электрона с атома водорода на атом хлора.
Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ.
Такая связь называется полярной ковалентной связью, а о молекуле хлороводорода говорят, что она полярна, т. е. имеет положительно заряженный конец (атом водорода) и отрицательно заряженный конец (атом хлора).
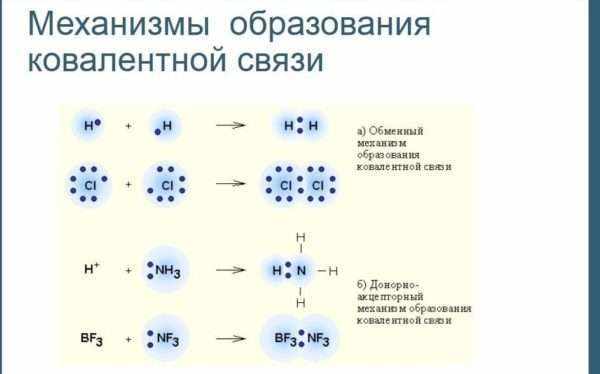
Обменный и донорно-акцепторный механизм образования ковалентной связи
- Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.
- Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Ковалентная связь – полярная и неполярная: что это такое и какова формула вещества
Вещества молекулярного строения образуются с помощью особого вида взаимосвязи. Ковалентная связь в молекуле, полярная и неполярная, также называется атомной. Это название происходит от латинского «co» «совместно» и «vales» «имеющий силу». При таком способе образования соединений пара электронов делится между двумя атомами.
Свойства
Что такое ковалентная полярная и неполярная связь? Если новое соединение образуется таким образом, то происходит обобществление электронных пар. Обычно такие вещества имеют молекулярное строение: Н2, О3, HCl, HF, CH4.
Есть и немолекулярные вещества, в которых атомы связаны таким образом. Это так называемые атомные кристаллы: алмаз, диоксид кремния, карбид кремния. В них каждая частица связана с четырьмя другими, в результате получается очень прочный кристалл. Кристаллы с молекулярной структурой обычно не отличаются высокой прочностью.
Свойства такого способа образования соединений:
- кратность,
- направленность,
- степень полярности,
- поляризуемость,
- сопряжение.
Кратность — это количество поделенных электронных пар. Их может быть от одной до трех. У кислорода до заполнения оболочки двух электронов не хватает, поэтому она будет двойной. У азота в молекуле N2 она тройная.
Поляризуемость — возможность образования ковалентной полярной связи и неполярной. При этом она может быть более или менее полярна, ближе к ионной или наоборот — в этом заключается свойство степени полярности.
Направленность означает, что атомы стремятся соединиться таким образом, чтобы между ними осталась как можно большая электронная плотность. О направленности имеет смысл говорить тогда, когда соединяются p или d-орбитали. S-орбитали сферически симметричны, для них все направления равноценны.
У p-орбиталей неполярная или полярная ковалентная связь направлена вдоль их оси, так что две «восьмерки» перекрываются вершинами. Это σ-связь. Существуют и менее прочные π-связи. В случае p-орбиталей «восьмерки» перекрываются боковыми сторонами вне оси молекулы.
В двойном или тройном случае p-орбитали образуют одну σ-связь, а остальные будут типа π.
Сопряжение — это чередование простых и кратных, делающее молекулу более стабильной. Такое свойство характерно для сложных органических соединений.

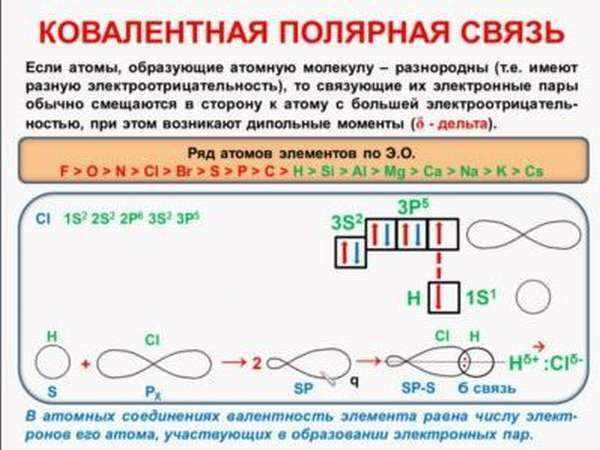
Полярность
Важно! Как определить, вещества с неполярной ковалентной или полярной связью перед нами? Это очень просто: первая всегда возникает между одинаковыми атомами, а вторая — между разными, имеющими неодинаковую электроотрицательность.
Примеры ковалентной неполярной связи — простые вещества:
- водород Н2,
- азот N2,
- кислород О2,
- хлор Cl2.
Схема образования ковалентной неполярной связи показывает, что с помощью объединения электронной пары атомы стремятся дополнить внешнюю оболочку до 8 или 2 электронов.
Например, фтору не хватает одного электрона до восьмиэлектронной оболочки. После образования поделенной электронной пары она заполнится.
Распространенная формула вещества с ковалентной неполярной связью — двухатомная молекула.

Полярно обычно связываются только элементы-неметаллы
В этом случае молекулу образуют разные элементы, но разница в электроотрицательности не так велика, чтобы электрон полностью перешел от одного атома к другому, как в веществах ионного строения.
Схемы образования ковалентной структуры этого типа показывают, что электронная плотность смещается к более электроотрицательному атому, то есть поделенная электронная пара находится к одному из них ближе, чем ко второму.
Части молекулы приобретают заряд, который обозначается греческой буквой дельта. В хлороводороде, например, хлор становится заряжен более отрицательно, а водород — более положительно. Заряд будет частичный, а не целый, как у ионов.
Важно! Не следует путать полярность связи и полярность молекулы. В метане СН4, например, атомы связаны полярно, а сама молекула неполярна.
Механизм образования
Образование новых веществ может проходить по обменному или донорно-акцепторному механизму.При этом объединяются атомные орбитали. Возникает одна или несколько молекулярных орбиталей. Они отличаются тем, что охватывают оба атома. Как и на атомной, на ней может находиться не более двух электронов, причем их спины тоже должны быть разнонаправленными.
Как определить, какой механизм задействован? Это можно сделать по числу электронов на внешних орбиталях.
Обменный
В этом случае электронная пара на молекулярной орбитали образуется из двух неспаренных электронов, каждый из которых принадлежит своему атому. Каждый из них стремится заполнить свою внешнюю электронную оболочку, сделать ее устойчивой восьми- или двухэлектронной. Так обычно образуются вещества с неполярной структурой.
Для примера рассмотрим соляную кислоту HCl. У водорода на внешнем уровне один электрон. У хлора — семь.
Нарисовав схемы образования ковалентной структуры для него, увидим, что для заполнения внешней оболочки каждому из них не хватает по одному электрону. Поделив между собой электронную пару, они смогут завершить внешнюю оболочку.
По такому же принципу образуются и двухатомные молекулы простых веществ, например, водорода, кислорода, хлора, азота и других неметаллов.
Донорно-акцепторный
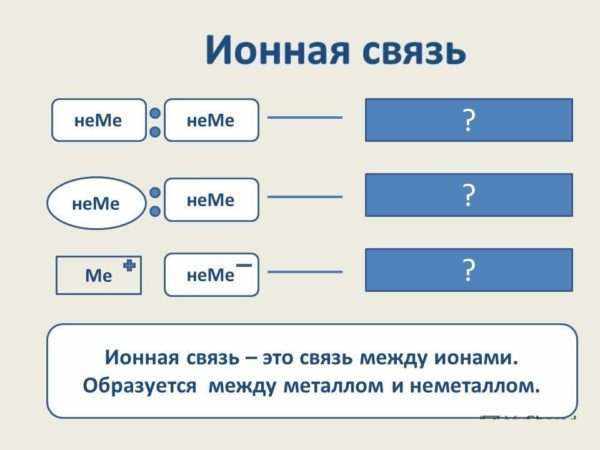
Во втором случае оба электрона представляют собой неподеленную пару и принадлежат одному атому (донору). У другого (акцептора) есть свободная орбиталь.
Формула вещества с ковалентной полярной связью, образованной таким образом, например, ион аммония NH4+. Он образуется из иона водорода, в котором есть свободная орбиталь, и аммиака NH3, содержащего один «лишний» электрон. Электронная пара из аммиака обобществляется.
Гибридизация
Когда электронная пара обобществляется между орбиталями различной формы, например, s и р, образуется гибридное электронное облако sp. Такие орбитали сильнее перекрываются, поэтому связываются прочнее.
Так устроены молекулы метана и аммиака. В молекуле метана СН4 должны были образоваться три связи по p-орбиталям и одна по s. Вместо этого орбиталь гибридизируется с тремя р-орбиталями, получаются три гибридные sp3-орбитали в форме вытянутых капель.
Это происходит потому, что электроны 2s и 2p имеют близкую энергию, они взаимодействуют друг с другом при соединении с другим атомом. Тогда можно образовать гибридную орбиталь. Получившаяся молекула имеет форму тетраэдра, водород располагается в его вершинах.
Другие примеры веществ с гибридизацией:
- ацетилен,
- бензол,
- алмаз,
- вода.
Для углерода характерна spЗ-гибридизация, поэтому она часто встречается в органических соединениях.
Вывод
Ковалентная связь, полярная или неполярная, характерна для веществ молекулярного строения. Неполярно связаны атомы одного элемента, а полярно — разных, но с ненамного отличающейся электроотрицательностью. Обычно таким образом соединяются элементы-неметаллы, но бывают и исключения, такие как алюминий.
Ковалентная связь: полярная, неполярная, механизмы ее появления
Ковалентная связь – определение, характеристика. Что такое ковалентная связь?
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» – совместно и «vales» – имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим атомам (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально.
Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспаренному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков.
Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается.
Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
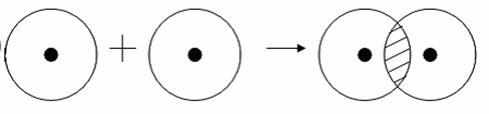
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Ковалентная неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи.
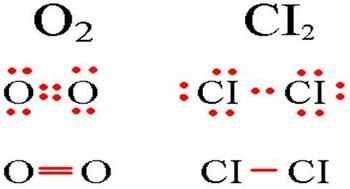
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Ковалентная полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленные электроны не принадлежат в равной степени двум атомам.
Большую часть времени обобществленные электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленные электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода.
А все дело в том, что электроотрицательность у хлора больше чем у водорода.

Ярким примером вещества с полярной ковалентной связью является вода.
Как определить ковалентную связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Свойства и строение вещества: ковалентная неполярная связь, отличие от полярной
Данная статья повествует о том, что такое ковалентная неполярная связь. Описываются ее свойства, типы атомов, которые ее образуют. Показано место ковалентной связи среди других видов соединений атомов.
Физика или химия?

Есть в обществе такой феномен: одна часть однородной группы считает другую менее понятливой, более неуклюжей. Например, англичане смеются над ирландцами, музыканты, играющие на струнных, – над виолончелистами, жители России – над представителями чукотского этноса. К сожалению, наука не исключение: физики считают химиков второсортными учеными. Однако, делают они это зря: отделить, где физика, а где химия порой весьма непросто. Таким примером могут служить способы соединения атомов в веществе (например, ковалентная неполярная связь): строение атома – однозначно физика, получение из железа и серы сульфида железа со свойствами, отличными и от Fe, и от S – точно химия, а вот как из двух разных атомов получается однородное соединение – ни то ни другое. Это нечто посередине, но традиционно науку о связях изучают как раздел химии.
Электронные уровни
Количество и расположение электронов в атоме определяют четыре квантовых числа: главное, орбитальное, магнитное и спиновое. Так, согласно сочетанию всех этих чисел, на первой орбитали существуют только два s-электрона, на второй два s-электрона и шесть p-электронов и так далее.
С ростом заряда ядра увеличивается и количество электронов, заполняя все новые и новые уровни. Химические свойства вещества определяются тем, сколько и каких электронов находится в оболочке их атомов.
Ковалентная связь, полярная и неполярная, образуется, если на внешних орбиталях двух атомов находятся по одному свободному электрону.
Образование ковалентной связи
Для начала надо отметить, что говорить «орбита» и «положение» в отношении электронов в электронной оболочке атомов некорректно. Согласно принципу Гейзенберга, определить точное местонахождение элементарной частицы невозможно. В данном случае корректнее было бы говорить об электронном облаке, как бы «размазанном» вокруг ядра на конкретном расстоянии. Итак, если у двух атомов (иногда одинаковых, иногда разных химических элементов) есть по одному свободному электрону, они могут объединять их на общую орбиталь. Таким образом, оба электрона принадлежат двум атомам сразу. Этим путем образуется, например, ковалентная неполярная связь.
Свойства ковалентных связей

Свойств у ковалентной связи четыре: направленность, насыщаемость, полярность, поляризуемость. В зависимости от их качества будут меняться химические свойства получающегося вещества: насыщаемость показывает, сколько связей способен создать этот атом, направленность показывает угол между связями, поляризуемость задается смещением плотности в сторону одного из участников связи. Полярность же связана с таким понятием, как электроотрицательность, и указывает на то, чем ковалентная неполярная связь отличается от полярной. В общих чертах электроотрицательность атома – это способность притягивать (или отталкивать) электроны соседей в устойчивых молекулах. Например, самыми электроотрицательными химическими элементами можно назвать кислород, азот, фтор, хлор. Если электроотрицательность двух разных атомов совпадает, появляется ковалентная неполярная связь. Чаще всего это происходит, если в молекулу соединяются два атома одного химического вещества, например H2, N2, Cl2. Но это не обязательно так: в молекулах PH3 ковалентная связь тоже неполярная.
Вода, кристалл, плазма

В природе существует несколько видов связей: водородная, металлическая, ковалентная (полярная, неполярная), ионная. Связь задается строением незаполненной электронной оболочки и определяет как структуру, так и свойства вещества. Как следует из названия, металлическая связь присуща только кристаллам определенных химических веществ. Именно тип связи атомов металлов между собой задает их способность проводить электрический ток. Фактически современная цивилизация построена на этом свойстве. Вода, самое важное вещество для человека, является результатом соединения ковалентной связью одного атома кислорода и двух водорода. Угол между двумя этими соединениями и задает уникальные свойства воды. Многие вещества, помимо воды, обладают полезными свойствами только потому, что их атомы соединяет ковалентная связь (полярная и неполярная).
Ионная связь чаще всего существует в кристаллах. Наиболее показательными являются полезные свойства лазеров. Сейчас они бывают разными: с рабочим телом в виде газа, жидкости, даже органического красителя. Но оптимальным соотношением мощности, размера и стоимости обладает все же твердотельный лазер. Однако ковалентная неполярная химическая связь, как и другие виды взаимодействия атомов в молекулах, присуща веществам в трех агрегатных состояниях: твердом, жидком, газообразном. Для четвертого агрегатного состояния вещества, плазмы, говорить о связи бессмысленно. Фактически это сильно ионизированный разогретый газ. Однако в состоянии плазмы могут находиться молекулы твердых при нормальных условиях веществ – металлов, галогенов и т.д.
Примечательно, что это агрегатное состояние вещества занимает наибольший объем Вселенной: звезды, туманности, даже межзвездное пространство представляют собой смешение разных видов плазмы. Мельчайшие частицы, которые способны пробить солнечные батареи спутников связи и вывести из строя систему GPS, являются пылевой низкотемпературной плазмой. Таким образом, привычный для людей мир, в котором важно знать тип химической связи веществ, представляет собой очень маленькую часть окружающей нас Вселенной.
Ковалентные неполярные и полярные связи
Общие электронные пары, образующиеся в простых веществах H2,O2,Cl2,F2,N2, в одинаковой степени принадлежат обоим атомам. Такая ковалентная связь называется неполярной. Ковалентная неполярная связь соединяет атомы в простых веществах-неметаллах.
Если ковалентная связь образуется между разными атомами, то общая электронная пара смещается к тому из них, который имеет более высокую электроотрицательность (ЭО). Он получает частичный отрицательный заряд. Атом, имеющий меньшую ЭО, становится заряжённым положительно. В этом случае образуется полярная ковалентная связь.
Ковалентная полярная связь образуется между атомами неметаллов в сложных веществах. Рассмотрим образование ковалентных связей в сложных веществах:
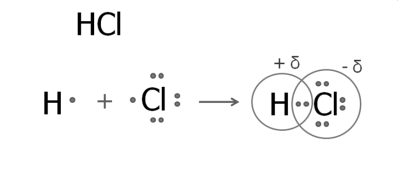
- Образование молекулы хлороводорода.
У атома водорода на внешнем уровне — один электрон. У хлора на внешнем уровне — семь электронов, один из которых неспаренный. Образуется одна общая электронная пара, которая смещена к атому хлора. В результате появляются частичные заряды: на атоме хлора — отрицательный, а на атоме водорода — положительный. Сдвиг электронной плотности принято обозначать греческой буквой дельта δ:
- Структурная формула хлороводорода H−Cl
Подобным образом соединяются атомы в молекулах других галогеноводородов:
- H−F,H−Br,H−I.
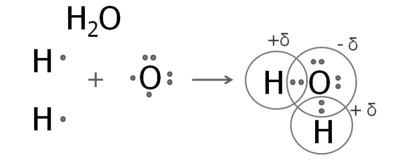
- Образование молекулы воды.
На внешнем уровне атома кислорода — шесть электронов, два из которых неспаренные. Атом кислорода образует две общие электронные пары с двумя атомами водорода.
Электронная плотность этих общих пар сдвинута к более электроотрицательному кислороду. Атом кислорода имеет отрицательный заряд, а атомы водорода — положительный.
Сходное строение имеет молекула сероводорода. Структурные формулы воды и сероводорода:
H−OH−S||HH
- Образование молекулы аммиака.
У атома азота — пять внешних электронов, три из которых неспаренные. Атом азота присоединяет к себе три атома водорода. Азот — более электроотрицательный элемент, поэтому на его атоме будет отрицательный заряд, а на атомах водорода — положительные заряды.
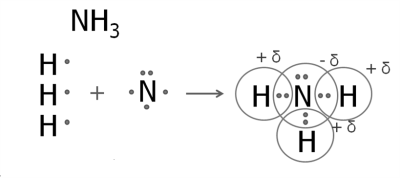
Так же образуются связи в фосфине. Структурные формулы аммиака и фосфина:
- H−N−HH−P−H||HH
Для того чтобы определить знаки частичных зарядов на атомах в веществе, надо сравнить ЭО неметаллов.
Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая
Химическая связь — электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов — s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
- Длина связи — среднее расстояние между ядрами двух химически связанных между собой атомов.
- Энергия химической связи — количество энергии, необходимое для того, чтобы разорвать связь и отбросить фрагменты молекулы на бесконечно большое расстояние.
- Валентный угол — угол между линиями, соединяющими химически связанные атомы.
- Известны следующие основные типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая и водородная.
- Ковалентной называют химическую связь, образованную за счёт образования общей электронной пары.
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью. Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, три — в молекуле азота N2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щёлочноземельных металлов.
Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга. Примеры соединений с ионной связью: NaCl, KBr, Na2O.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решётку. В этой решётке их удерживают общие для всего металла электроны (электронный газ).
Типы химической связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность– это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Ковалентная полярная и неполярная химическая связь: примеры, донорно-акцепторный механизм образований
Химическим элементарным частицам свойственно соединяться друг с другом посредством формирования специальных взаимосвязей. Они бывают полярными и неполярными. Каждая из них имеет определенный механизм формирования и условия возникновения.
Что это
Ковалентная связь — это образование, возникающее у элементов с неметаллическими свойствами. Наличие приставки «ко» свидетельствует о совместном участии атомных электронов разных элементов.
Понятие «валенты» означает наличие определенной силы. Возникновение такой взаимосвязи происходит посредством обобществления атомных электронов, не имеющих «пары».
Указанные химические связи возникают за счет появления «копилки» электронов, являющейся общей для обеих взаимодействующих частиц. Появление пар электронов осуществляется вследствие накладывания друг на друга электронных орбиталей. Указанные виды взаимодействия возникают между электронными облаками обоих элементов.
Важно! Ковалентная взаимосвязь появляется в случае объединения пары орбиталей.
Веществами с описанной структурой являются:
- многочисленные газы,
- вода,
- спирты,
- углеводы,
- белки,
- органические кислоты.
Ковалентная химическая связь образуется за счет формирования общественных пар электронов у простых веществ либо сложных соединений. Она бывает полярная и неполярная.
Как определить природу химической связи? Для этого необходимо посмотреть на атомную составляющую частиц, присутствующих в формуле.
- Химические связи описанного вида формируются только между элементами, где преобладают неметаллические свойства.
- Если в соединении присутствуют атомы одинаковых либо разных неметаллов, значит возникающие между ними взаимосвязи – «ковалентные».
- Когда в соединении одновременно присутствуют металл и неметалл говорят об образовании ионной взаимосвязи.
Структура с «полюсами»
Ковалентная полярная связь соединяет друг с другом атомы разных по природе неметаллов. Это могут быть атомы:
- фосфора и кислорода,
- хлора и водорода,
- аммиака.
Есть и другое определение для указанных веществ. Оно говорит о том, что данная «цепочка» формируется между неметаллами с разными показателями электроотрицательности. В обоих случаях «подчеркивается» разновидность химических элементов-атомов, где возникла эта взаимосвязь.
Формула вещества с ковалентной полярной связью – это:
- HCI,
- CO,
- HBr,
- HF,
- NO и многие другие.
Представленные соединения в нормальных условиях могут иметь жидкие либо газообразные агрегатные состояния. Формула Льюиса помогает точнее понять механизм связывания атомных ядер.
Как появляется
Механизм образования ковалентной связи для атомных частиц с разными значениями электроотрицательности сводится к формированию общей плотности электронной природы.
Обычно она смещается к элементу, имеющему наибольший показатель электроотрицательности. Его можно определить по специальной таблице.
Из-за смещения общей пары «электрончиков» в сторону элемента с большим значением электроотрицательности, на нем частично формируется отрицательный заряд.
Соответственно другой элемент получит частичный положительный заряд. Вследствие этого образуется соединение с двумя разнозаряженными полюсами.
Нередко при образовании полярной взаимосвязи используется акцепторный механизм или донорно-акцепторный механизм. Примером вещества, образованного по данному механизму, служит молекула аммиака. В нем азот наделен свободной орбиталью, а водород – свободным электроном.
Образующая общая электронная пара занимает данную орбиталь азота, в результате чего один элемент становится донором, а другой акцептором.
Описанный механизм образования ковалентной связи, как вид взаимодействия, характерен не для всех соединений с полярным связыванием. Примерами могут служить вещества органического, а также неорганического происхождения.
О неполярной структуре
Ковалентная неполярная связь связывает между собой элементы с неметаллическими свойствами, имеющими одинаковые значения электроотрицательности. Другими словами, вещества с ковалентной неполярной связью — это соединения, состоящие из разного количества идентичных неметаллов.
Примеры соединений, относящиеся к указанной категории являются веществами простого строения. В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
В некоторой литературе их именуют валентными. Под валентностью подразумевают количество электронов, необходимых для завершения внешней оболочки. Атом может отдавать или принимать отрицательно заряженные частицы.
Описанная взаимосвязь относится к категории двухэлектронных либо двухцентровых цепочек. При этом пара электронов занимает общее положение между двумя орбиталями элементов. В структурных формулах электронную пару записывают в виде горизонтальной черты или «-». Каждая такая черточка показывает количество общих электронных пар в молекуле.
Для разрыва веществ с указанным видом взаимосвязи требуется затратить максимальное количество энергии, поэтому эти вещества являются одними из прочных по шкале прочности.
Внимание! В данную категорию относят алмаз – одно из самых прочных соединений в природе.
Как появляется
По донорно-акцепторному механизму неполярные взаимосвязи практически не соединяются. Ковалентная неполярная связь — это структура, формирующаяся посредством возникновения общих пар электронов. Данные пары в одинаковой степени принадлежат обоих атомам. Кратное связывание по формуле Льюиса точнее дает представление о механизме соединения атомов в молекуле.
Сходством ковалентной полярной и неполярной связи является появление общей электронной плотности. Только во втором случае образующиеся электронные «копилки» в одинаковой мере принадлежат обоим атомам, занимая центральное положение. В результате не образуются частичные положительные и отрицательные заряды, а значит образующиеся «цепи» являются неполярными.
Важно! Неполярная взаимосвязь приводит к образованию общей электронной пары, за счет чего последний электронный уровень атома становится завершенным.
Что такое ковалентная полярная связь
Ковалентная полярная связь это одна из разновидностей химической связи между атомами вещества, благодаря которой формируются молекулы. Если со словом «связь» проблем с пониманием не возникает, то термины «ковалентная» и «полярная» неподготовленному человеку неизвестны (конечно, при условии, что школьная программа химии не забылась).
Итак, слово «ковалентный» является производным от «ко-» и «-валента», что дословно означает взаимно направленную силу. Действительно, это та сила, которая способна объединить два атома в молекулу, переконфигурировав их электронные оболочки в единую конструкцию.
Так как оба ядра становятся равноправными, вращающиеся вокруг них электроны заполняют не только «внешние» стороны, но и промежуток между атомами. Можно сказать, что именно он и является ковалентной связью.
При этом такая сдвоенная система стремится к завершенности электронной конфигурации, так как носители заряда дополняют оболочки взаимодействующих атомов. Отметим, что лишь пара электронов реализует данный вид связи.
Еще одним вариантом этого же явления можно назвать ионный тип связи. Так как ион образуется, когда атом утрачивает электрон, то она возникает при обмене носителями отрицательного заряда, что характерно для атомов разных веществ (к примеру, фтора и натрия).
Полярная ковалентная связь – это промежуточный вариант. Данная разновидность напоминает «чисто ковалентную» тем, что формируется молекулярная орбиталь (объединение орбит), а от ионной в ней частичное «перетягивание» носителей заряда. Пара смещается к одному из атомов, но полностью не покидает зону другого. Пример, в котором участвует ковалентная полярная связь – молекула воды.
Завершенные оболочки создаются при объединении одного атома кислорода и двух водорода. Однако так как кислород обладает более выраженным свойством притягивать электроны, их пара смещается именно к ядру «О». Кстати, вовсе не обязательно атомы формируют одну пару электронов: их может быть две, три и т.д.
Ковалентная полярная связь создает в системе распределение зарядов (частичное) и, как следствие, полярность. Наблюдается ориентированность молекулы согласно линиям напряженности поля. Можно сказать, что благодаря такому распределению возникает своеобразный молекулярный диполь. Его момент (мю) формирует электрическое поле и напряженность.
Существует ряд формул для расчета момента диполя (в частности, произведение расстояния на заряд), они позволяют рассчитать значение полярности образованной молекулы.
Другими словами, ковалентная полярная связь может быть образована атомами, электроотрицательность которых хотя и различна, но не настолько, чтобы сформировать ионную связь. Поясним, что такое электроотрицательность. Данный термин указывает на способность того или иного атома притягивать к своему ядру сформированную (-ые) пару носителей отрицательного заряда.
Очевидно, что в соответствии с законом сохранения энергии, чем больше межатомных связей, тем меньше их длина. Обычно ковалентная полярная связь характерна для атомов, химические характеристики которых схожи. Она характеризуется пространственной ориентированностью.
Благодаря этому возможно образование не только молекул, но и кристаллических решеток, в которых атомы размещаются в геометрически правильном порядке.
Так как связь, фактически, представляет собой наложение друг на друга двух (или более) электронных облаков, принадлежащих различным атомам, то ее прочность главным образом зависит от того, насколько сильно происходит наложение. Нетрудно понять, что благодаря созданию пар, в межъядерном промежутке значение электронной плотности возрастает.