Галогены (от греч. halos — соль и genes — образующий) — элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат. Общая электронная конфигурация внешнего энергетического уровня — nS2nP5.
Галогены — сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства).
| Символ элемента | F | Cl | Br | I | At |
| Порядковый номер | 9 | 17 | 35 | 53 | 85 |
| Строение внешнего электронного слоя | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 | 6s26p5 |
| Энергия ионизации, эв | 17,42 | 12,97 | 11,84 | 10,45 | ~9,2 |
| Относительная электроотрицательность (ЭО) | 4,0 | 3,0 | 2,8 | 2,5 | ~2,2 |
| Радиус атома, нм | 0,064 | 0,099 | 0,114 | 0,133 | – |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3 +5, +7 | -1, +1, +3, +5, +7 | – |
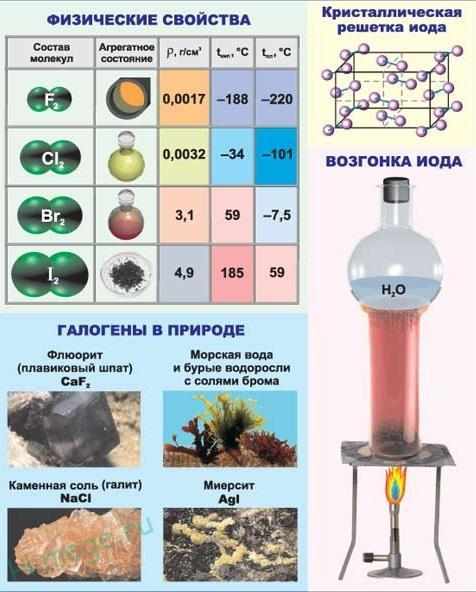
Молекулы галогенов состоят из двух атомов. С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
Получение
Фтор получают электролизом расплава гидрофторида калия KHF2 (разлагается лишь HF):
- 2HF → H2 + F2
- Анод: 2F— — 2ē → F2
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия:
- 2NaCl + 2Н2О → Н2↑ + 2NaОН + Сl2↑
В лаборатории хлор получают действием различных окислителей на соляную кислоту:
- МnО2 + 4НСl → МnСl2 + Сl2↑ + 2Н2О
- 2KMnO4 + 16HCl →2MnCl2 + 5Cl2 + 2KCl + 8H2O
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
Аналогично получают бром и иод, окисляя НВr, НI или их соли:
- 6КВr + К2Сr2О7 +7Н2SО4 → ЗВr2 + Сr2(SО4)3 + 4К2SО4 + 7Н2О.
Химические свойства F2
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду.
Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты:
- 2Аl + 3F2 → 2АlF3
- 2Fе + 3F2 → 2FеF3
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические:
- Н2 + F2 → 2НF (со взрывом)
- Si + 2F2 → SiF4(г)
При нагревании фтор окисляет все другие галогены (их степень окисления +1):
Cl2 + F2 → 2ClF
При облучении фтор реагирует даже с инертными (благородными) газами:
Хе + F2 → ХеF2
Взаимодействие фтора со сложными веществами также протекает очень энергично:
3F2 + ЗН2О → F2О↑ + 4НF + Н2О2 (со взрывом)
Химические свойства Сl2
Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов:
- 2Аl + ЗСl2 → 2АlСl3(кр)
- 2Fе + ЗСl2 → 2FeСl3(кр)
- Si + 2Сl2 → SiCl4(ж)
- Н2 + Сl2 → 2НСl(г)
Реакция замещения и присоединения с углеводородами:
- СН3-СН3 + Сl2 → СН3-СН2Сl + НСl,
- СН2=СН2 + Сl2 → СН2Cl — СН2Сl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
- Сl2 + 2НВr → 2НСl + Вr2,
- Сl2 + 2НI → 2НСl + I2,
- Сl2 + 2КВr → 2КСl + Вr2
Обратимо реагирует с водой:
Сl2 + Н2О↔ НСl + НСlO (хлорная вода)
С щелочами:
- Сl2 + 2NаОН → NаСl + NаСlO + Н2О (на холоде),
- ЗСl2 + 6КОН → 5КСl + КClO3 + ЗН2О (при нагревании).
Химические свойства Br2
По химической активности бром занимает промежуточное положение между хлором и иодом. Взаимодействует со многими простыми веществами:
- 2Аl + ЗВr2 → 2АlВr3(кр)
- Si +2Вr2 → SiBr4(ж)
- Н2 + Вr2 → 2НВr(г)
Бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду»:
Br2 + H2O = HBr + HBrO
При растворении в растворах щелочей на холоду происходит образование бромида и гипобромита:
2NaOH + Br2 =NaBr + NaBrO + H2O
При повышенных температурах (около 100°С) — бромида и бромата:
6NaOH + 3Br2 = 5NaBr + NaBrO3 + 3H2O.
При реакции брома с растворами иодидов выделяется свободный иод:
Br2+ 2KI = I2+ 2KBr.
С органическими веществами, имеющими двойную или тройную связь. Обесцвечивание бромной воды – качественная реакция на непредельное соединение:
C2H4 + Br2 = C2H4Br2.
Химические свойства I2
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании.
Взаимодействие же йода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 ↔2НI
Йод практически в воде не растворим и не способен ее окислять даже при нагревании, по этой причине не существует «йодной воды».
Но йод способен растворяться в растворах иодидов с образованием комплексных анионов:
- I2 + I− → I−3.
Образующийся раствор называется раствором Люголя.
Сероводород H2S, тиосульфат натрия Na2S2O3 и другие восстановители восстанавливают его до I— :
I2 + H2S = S + 2HI
Хлор и другие сильные окислители в водных растворах переводят его в IO3— :
5Cl2 + I2 + 6H2O = 2HIO3 + 10НСl
Адсорбируясь на крахмале, йод окрашивает его в темно-синий цвет- качественная реакция на йод.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к йоду. Каждый галоген в ряду F — I может вытеснять последующий из его соединений с водородом или металлами, т.е. каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов.

- Химические свойства галогенов
- Химические свойства водорода и галогенов
- Взаимодействие водорода с простыми веществами
- Взаимодействие водорода со сложными веществами
- С оксидами металлов
- С оксидами неметаллов
- С кислотами
- С солями
- Химические свойства галогенов
- Взаимодействие галогенов с простыми веществами
- Взаимодействие галогенов с неметаллами
- Водородом
- Фосфором
- Серой
- Взаимодействие галогенов с металлами
- Реакции галогенов со сложными веществами
- Реакции замещения с галогенами
- Взаимодействие галогенов с водой
- Взаимодействие галогенов с растворами щелочей
- Галогены: список элементов и химические свойства фтора, брома и йода, таблица Менделеева
- Перечень галогенов
- Фтор
- Хлор
- Бром, йод и астат
- Применение
- Физические и химические свойства галогенов
- Химические свойства галогенов
- Физические свойства галогенов
- Получение галогенов
- Применение галогенов
Химические свойства галогенов
Как уже было замечено в предыдущих лекциях (подгруппа кислорода) у первого элемента — F (фтора) все соответствует общей формуле — на внешнем уровне 7 электронов. А вот у хлора (Cl) — элемента 3-го периода появляется свободная d-орбиталь и возможность распаривать на нее электроны.
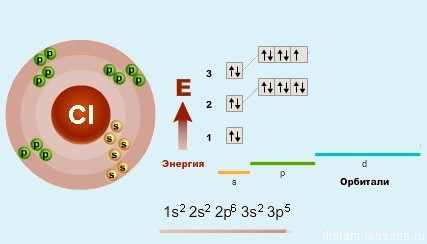
Благодаря этой возможности — распаривать электроны p-подуровня на d-подуровень, для всех элементов кроме фтора возможны степени окисления +1, +3, +5 и +7.
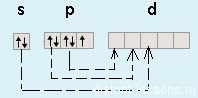
Итак, выводы:
- Валентность элементов:
- валентность фтора = 1,
- валентность хлора и остальных галогенов — 1,3,5 и 7
- Степени окисления:
- степень окисления фтора = -1 — типичный неметалл, самый сильный неметалл — просто КОРОЛЬ неметаллов — самый верхний в группе и самый левый в периоде.,
- степень окисления хлора и остальных галогенов = -1 (минимальная степень окисления), +1 , +3, +5 и +7 (максимальная степень окисления) в минимальной с.о. элементы будут проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства галогенов
- Фтор — F2 — светло-желтый газ,
- Хлор Cl2 — желто-зеленый газ,
- Бром — Br2 — бурая жидкость,
- Йод — J2 — темно-фиолетовые кристаллы, металлический блеск.
Химические свойства галогенов
Фтор — самый активный неметалл, нет веществ, с которыми он не вступал бы в реакции, он НИКОГДА не проявляет положительные степени окисления. Это КОРОЛЬ неметаллов.
- Взаимодействие с водородом:
F2 + H2 = 2HF — плавиковая кислота
- Взаимодействие с металлами:
F2 + 2Li = 2LiF — фторид лития (галогениды)
- Взаимодействие с неметаллами:
F2 + O2 = OF2 (кислород здесь проявляет с.о. +2)
- Окислительный свойства:
Сl2 + H2S = S + 2HCl
Взаимодействие с водой:
- раствор HF — плавиковая кислота
- Cl2 + H2O ↔ HCl + HClO — оксокислоты хлора
Не смотря на то, что эти реакции написаны для фтора и хлора, естественно, они применимы и к брому, и к йоду (кроме взаимодействия с кислородом — там придется элементы поменять местами).
Как и во всех других группах, химические свойства соединений галогенов подчиняются законам периодичности:
- сверху вниз в подгруппе восстановительные свойства усиливаются.
- сила кислот сверху вниз увеличивается
- с увеличением степени окисления элемента в оксосоединениях усиливаются окислительные свойства.
Отдельно мы разберем Кислоты хлора — их немало, и их названия, а тем более называния солей, желательно знать наизусть
Химические свойства водорода и галогенов
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов.
Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов.
Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы.
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra).
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
- Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
- При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
С оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
С оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
С кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
С солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
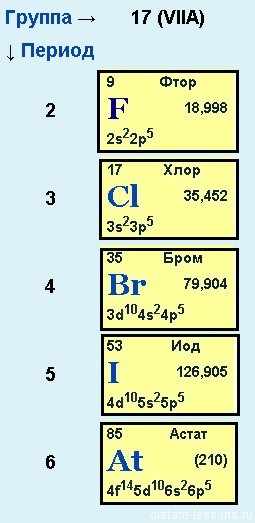
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген.
Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике.
Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 >, Cl2 >, Br2 >, I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ.
Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены.
К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
Водородом
- При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
- Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
- Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой.
Фосфором
- Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
- При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
- При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
- Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
Серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы.
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
- Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
- Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
- Аналогичным образом, бром и йод вытесняют серу из растворов сульфидов и или сероводорода:
- Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции.
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы.
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя.
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям.
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Галогены: список элементов и химические свойства фтора, брома и йода, таблица Менделеева
Из учебника химии многие знают, что к галогенам относятся химические элементы периодической системы Менделеева из 17 группы в таблице.
С греческого переводится как рождение, происхождение. Практически все они высокоактивны, благодаря чему бурно реагируют с простыми веществами за исключением нескольких неметаллов. Что же такое галогены и каковы их свойства?
Перечень галогенов
Галогены являются хорошими окислителями, по этой причине в природе их можно встретить только в каких-либо соединениях. Чем выше порядковый номер, тем химическая активность элементов этой группы меньше. К группе галогенов относятся нижеперечисленные элементы:
- хлор (Cl),
- фтор (F),
- иод (I),
- бром (Br),
- астат (At).
Последний разработан в институте ядерных исследований, который расположен в городе Дубна. Фтор относится к ядовитым газам бледно-жёлтого цвета. Хлор также ядовит. Это газ, имеющий довольно резкий и неприятный запах светло-зелёного цвета.
Бром имеет красно-бурый окрас, это ядовитая жидкость, которая может даже поражать обоняние. Он очень летуч, поэтому его хранят в ампулах. Йод — кристаллическое легко возгоняющееся вещество тёмно-фиолетового цвета.
Астат радиоактивен, цвет кристаллов: чёрный с синевой, период полураспада составляет 8,1 часа.
Фтор
Высокая активность окисления галогенов падает от фтора к иоду.
Самым активным из собратьев является фтор, который имеет свойство вступать в реакцию с любыми металлами, образуя соли, некоторые из них при этом самовоспламеняются, при этом выделяется огромное количество тепла.
Без нагрева этот элемент реагирует почти со всеми неметаллами, реакции сопровождаются выделением некоторого количества теплоты (экзотермические).
С инертными газами фтор вступает во взаимодействие, при этом облучаясь (Хе + F 2 = XeF 2 + 152 кДж). Нагреваясь, фтор влияет на другие галогены, окисляя их. Имеет место формула: Hal 2 + F 2 = 2НalF, где Hal = Cl, Br, I, At, в случае, когда HalF степени окисления хлора, брома, иода и астата равны + 1.
Со сложными веществами фтор также взаимодействует довольно энергично. Следствием является окисление воды. При этом происходит взрывная реакция, которая коротко записывается формулой: 3F 2 + ЗН 2 О = OF 2 ↑ + 4HF + Н 2 О 2.
Хлор
Активность свободного хлора несколько меньше, в сравнении со фтором, но он также имеет хорошую способность вступать в реакцию.
Это может происходить при взаимодействии со многими простыми веществами, за редким исключением в виде кислорода, азота, инертных газов.
Он может бурно реагировать со сложными веществами, создавая реакции замещения, свойство присоединения углеводородов — это тоже присуще хлору. При нагреве происходит вытеснение брома или йода из соединений с водородом или металлами.
Своеобразные отношения у этого элемента с водородом. При комнатной температуре и без попадания света, хлор никак не реагирует на этот газ, но стоит его лишь нагреть или направить свет, произойдёт взрывная цепная реакция. Формула приведена ниже:
Cl 2 + h ν → 2Cl , Cl + Н 2 → HCl + Н , Н + Cl 2 → HCl + Cl , Cl + Н 2 → HCl + Н и т . д .
Фотоны, возбуждаясь, вызывают разложение на атомы молекул Cl 2, при этом возникает цепная реакция, вызывая появление новых частиц, которые инициируют начало следующей стадии. В истории химии это явление было исследовано. Русский химик и лауреат Нобелевской премии Семёнов Н.Н. в 1956 году занимался изучением цепной фотохимической реакции и внёс тем самым большой вклад в науку.
Хлор реагирует со многими сложными веществами, это реакции замещения и присоединения. Он хорошо растворяется в воде.
Cl 2 + Н 2 О = HCl + HClO — 25 кДж.
Со щелочами при нагреве хлор может диспропорционировать.
Бром, йод и астат
Химическая активность брома чуть меньше, чем у вышеназванных фтора или хлора, однако она тоже довольно велика. Бром часто применяют в жидком виде. Он, как и хлор, очень хорошо растворяется в воде. Происходит частичная реакция с ней, позволяющая получать «бромную воду».
Химическая активность йода заметно отличается от остальных представителей этого ряда. Он почти не взаимодействует с неметаллами, а с металлами реакция идёт очень медленно и только при нагреве.
При этом происходит большое поглощение тепла (эндотермическая реакция), которая сильно обратима. К тому же йод нельзя никаким образом растворить в воде, этого не достичь даже при нагреве, поэтому в природе не бывает «йодной воды». Йод можно растворить только в растворе йодида.
При этом образуются комплексные анионы. В медицине такое соединение называется раствором Люголя.
Астат реагирует с металлами и водородом. В ряду галогенов химическая активность уменьшается по направлению от фтора к астату. Каждый галоген в ряду F — At способен вытеснять последующие элементы из соединений с металлами или водородом. Астат — самый пассивный среди этих элементов. Но ему присуще взаимодействие с металлами.
Применение
Химия прочно входит в нашу жизнь, внедряясь во все сферы. Человек научился применять галогены, а также его соединения на своё благо. Биологическое значение галогенов неоспоримо. Области применения их различны:
- медицина,
- фармакология,
- производство различных пластмасс, красителей и т. д.,
- сельское хозяйство.
Из природного соединение криолита, химическая формула которого выглядит следующим образом: Na3AlF6, получают алюминий. Соединения фтора нашли широкое распространение при производстве зубных паст. Фтор, как известно, служит для профилактики кариеса. Спиртовую настойку йода применяют для дезинфекции и обеззараживания ран.
Наиболее широкое применение в нашей жизни нашёл хлор. Область его применения довольно многообразна. Примеры использования:
- Производство пластмасс.
- Получение соляной кислоты.
- Производство синтетического волокна, растворителей, каучуков и др.
- Отбеливание тканей (льняных и хлопчатобумажных), бумаги.
- Обеззараживание питьевой воды. Но всё чаще для этой цели используется озон, так как применение хлора вредно для организма человека.
- Дезинфекция помещений
Нужно помнить, что галогены — очень токсичные вещества. Особенно ярко это свойство выражено у фтора. Галогены могут оказывать удушающее и воздействие на органы дыхания и поражать биологические ткани.
Огромную опасность могут иметь пары хлора, а также аэрозоль фтора, имеющий слабый запах, он может ощутиться при большой концентрации. Человек может получить эффект удушья. При работе с такими соединениями нужно соблюдать меры предосторожности.
Методы производства галогенов сложные и многообразные. В промышленности к этому подходят с определёнными требованиями, соблюдение которых неукоснительно соблюдаются.
Физические и химические свойства галогенов
Электронная конфигурация внешнего энергетического уровня галогенов ns2np5. Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей.
Степени окисления галогенов: от «-1» до «+7». Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления «-1» и является самым электроотрицательным элементом. Молекулы галогенов двухатомны: F2, Cl2, Br2, I2.
Химические свойства галогенов
С ростом заряда ядра атома химического элемента, т.е. при переходе от фтора к йоду окислительная способность галогенов снижается, что подтверждается способностью вытеснения нижестоящих галогенов вышестоящими из галогеноводородных кислот и их солей:
- Br2 + 2HI = I2 + 2HBr,
- Cl2 + 2KBr = Br2 + 2KCl.
Наибольшей химической активностью обладает фтор. Большинство химических элементов даже при комнатной температуре взаимодействует с фтором, выделяя большое количество теплоты. Во фторе горит даже вода:
2H2O + 2F2 = 4HF + O2↑.
Свободный хлор менее реакционноспособен, чем фтор. Он непосредственно не реагирует с кислородом, азотом и благородными газами. Со всеми остальными веществами он взаимодействует подобно фтору:
- 2Fe + Cl2 = 2FeCl3,
- 2P + 5Cl2 = 2PCl5.
При взаимодействии хлора с водой на холоде происходит обратимая реакция:
Cl2 + H2O↔HCl +HClO.
Смесь, представляющую собой продукты реакции, называют хлорной водой.
При взаимодействии хлора с щелочами на холоде образуются смеси хлоридов и гипохлоритов:
Cl2 + Ca(OH)2 = Ca(Cl)OCl + H2O.
При растворении хлора в горячем растворе щелочи происходит реакция:
3Cl2 + 6KOH = 5KCl +KClO3+3H2O.
Бром, как и хлор растворяется в воде и, частично реагируя с ней, образует так называемую «бромную воду», тогда как йод в воде практически нерастворим.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие йода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Физические свойства галогенов
- При н.у. фтор – газ светло-желтого цвета, обладающий резким запахом.
- Ядовит.
- Хлор – газ светло-зеленого цвета, также как и фтор имеет резкий запах.
- Сильно ядовит.
- При повышенном давлении и комнатной температуре легко переходит в жидкое состояние.
Бром – тяжелая жидкость красно-бурого цвета с характерным неприятным резким запахом. Жидкий бром, а также его пары сильно ядовиты. Бром плохо растворяется в воде и хорошо в неполярных растворителях. Йод – твердое вещество темно-серого цвета с металлическим блеском. Пары йода имеют фиолетовый цвет. Йод легко возгоняется, т.е. переходит в газообразное состояние из твердого, при этом минуя жидкое состояние.
Получение галогенов
Галогены можно получить при электролизе растворов или расплавов галогенидов:
MgCl2 = Mg + Cl2 (расплав).
Наиболее часто галогены получают по реакции окисления галогенводородных кислот:
- MnO2 + 4HCl = MnCl2 + Cl2↑ +2H2O,
- K2Cr2O7 + 14HCl = 3Cl2↑ + 2KCl +2CrCl3 +7H2O,
- 2KMnO4 +16HCl = 2MnCl2 +5Cl2↑ +8H2O +2KCl.
Применение галогенов
Галогены используют в качестве сырья для получения различных продуктов. Так, фтор и хлор используют для синтеза различных полимерных материалов, хлор также является сырьем при производстве соляной кислоты. Бром и йод нашли широкое применение в медицине, бром также используется лакокрасочной промышленности.
Источник: http://ru.solverbook.com/spravochnik/svojstva-po-ximii/fizicheskie-i-ximicheskie-svojstva-galogenov/