Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле CnH2n+2. В молекулах алканов все атомы углерода находятся в состоянии sр3-гибридизации.
Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109° 28′.
- Гомологический ряд метана
- Изомерия и номенклатура
- Основы номенклатуры
- Физические свойства алканов
- Химические свойства алканов
- Углеводороды. Алканы. Строение, получение и свойства
- Гомологический ряд алканов
- Алканы: строение и химические свойства, получение насыщенных углеводородов
- Гомологический ряд предельных углеводородов
- Номенклатура насыщенных углеводородов, их производные
- Алканы: химические свойства
- Получение метана
Гомологический ряд метана
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н-пентана.
Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это σ-связи.
Связи углерод — углерод являются неполярными и плохо поляризуемыми. Длина С—С связи в алканах равна 0,154 нм (1,54 • 10—10 м). Связи С—Н несколько короче.
Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
Гомологи — вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкан, для которого характерны структурные изомеры, — это бутан.
Основы номенклатуры
Выбор главной цепи. Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
Нумерация атомов главной цепи. Атомам главной цепи присваивают номера.
Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В).
Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—СН3), затем этил (-СН2-СН3), пропил (-СН2-СН2-СН3) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс —ил в названии соответствующего алкана.
Формирование названия. В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители.
Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил).
Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана ( метан СН4, этан С2Н6, пропан C3H8, бутан С4Н10, пентан С5Н12, гексан С6Н14, гептан C7H16, октан C8H18, нонан С9Н20, декан С10Н22).
Физические свойства алканов
Первые четыре представителя гомологического ряда метана — газы.
Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», почувствовав который, надо звонить 04, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С4Н12 до С15Н32 — жидкости, более тяжелые углеводороды — твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства алканов
Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу. Приведем уравнения характерных реакций галогенирования:
![]() В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
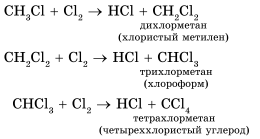
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
Реакция дегидрирования (отщепления водорода).
В ходе пропускания алканов над катализатором (Pt, Ni, А1203, Сг203) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена: ![]()
Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
![]() В общем виде реакцию горения алканов можно записать следующим образом:
В общем виде реакцию горения алканов можно записать следующим образом:
- Термическое расщепление углеводородов.
- Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
- Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена.
- Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
Пиролиз. При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества:
При нагревании до температуры 1500 °С возможно образование ацетилена:
Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод — углерод) связей и слабополярных С—Н (углерод — водород) связей.
В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Углеводороды. Алканы. Строение, получение и свойства
Углеводороды — органические соединения, в состав которых входят только два элемента: углерод и водород.
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями, состав которых выражается общей формулой CnH2n+2, где n – число атомов углерода.
Алканы являются углеводородами, наиболее богатыми водородом, они насыщены им до предела. Отсюда название – насыщенные или предельные углеводороды. Их также называют парафинами. Общая черта в строении алканов и циклоалканов – простая или одинарная связь между атомами углерода.
На образование этой связи затрачивается одна пара электронов, причем максимальное перекрывание орбиталей находится на линии, соединяющей центры атомов. Такую связь называют σ-связью, а электроны, образующие её – σ-электронами.
Распределение электронной плотности σ‑ связи симметрично относительно оси, проходящей через центры связанных атомов
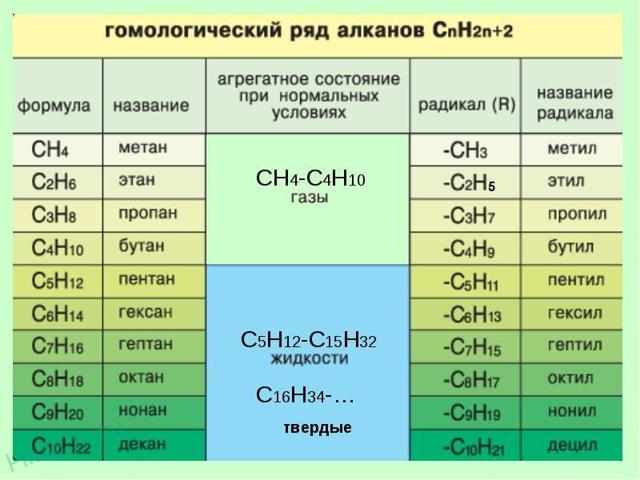
Все атомы углерода находятся в состоянии sp3— гибридизации, валентный угол равен 109о28’, длина связи С – С составляет 1,54 Ао. Ниже приводятся формулы и названия первых десяти членов гомологического ряда предельных углеводородов и соответсвующих им алкильных радикалов.
Гомологический ряд алканов
| Мелекулярная формула иНазвание алкана | Формула и название алкильного радикала |
| СН4 , метан | — СН3, метил |
| С2Н6, этан | — С2Н5, этил |
| С3 Н8, пропан | — С3 Н7, пропил |
| С4 Н10, бутан | — С4 Н9, бутил |
| С5 Н12, пентан | — С 5Н11, пентил (амил) |
| С6 Н14, гексан | — С6 Н13, гексил |
| С7 Н16, гептан | — С 7Н15, гептил |
| С8 Н18, октан | — С8 Н17, октил |
| С9 Н20, нонан | — С9 Н19, нонил |
| С10 Н22, декан | — С10 Н21, децил |
Для простейших алканов (С1-С4) приняты тpивиальные названия: метан, этан, пpопан, бутан, изобутан.
Начиная с пятого гомолога, названия нормальных (неpазветвленных) алканов стpоят в соответствии с числом атомов углеpода, используя гpеческие числительные и суффикс -ан: пентан, гексан, гептан, октан, нонан, декан и т.д.
В основе названия разветвленного алкана лежит название входящего в его конструкцию нормального алкана с наиболее длинной углеродной цепью. При этом углеводоpод с pазветвленной цепью pасcматpивают как пpодукт замещения атомов водоpода в ноpмальном алкане углеводоpодными pадикалами.
Напишем формулы изомеров гексана:
- СН3-СН2-СН2-СН2-СН2-СН3 — н-гексан
- СН3-СН(СН3) -СН2-СН2-СН3 СН3-СН2-СН(СН3)-СН2-СН3
- 2-метилпентан 3-метилпентан
- СН3 –С( СН3)2– СН2— СН3 СН3-СН(CH3)-СН(CH3)- СН3
- 2,2-диметилбутан 2,3 –диметилбутан
Спосoбы получения алканов:
1. По реакции Вюрца – действием металлического натрия на галоидные алкилы:
- СН3 – СI + 2Nа + СI – СН3 → СН3 – СН3 + 2NаСI
2. Сплавлением натриевых солей карбоновых кислот с едкими щелочами:
- СН3 –СН2 – СООNа + NаОН → СН 3–СН3 + Nа2СО3.
3. Гидролиз карбида алюминия, получается метан:
- АI4С3 + 12Н2О → 3СН4 + 4АI(ОН)3.
4. Гидрирование непредельных углеводородов в присутствии катализаторов:
- СnН2n + Н2 → СnН2n+2
5. Синтез из оксида углерода (II) и водорода:
- nСО + (2n+1)Н2 → CnH2n+2 + nН2О
Химические свойства алканов:
1. Галогенирование (реакция радикального замещения):
- СН4 + СI2 → СН3СI + HCl
2. Нитрование (реакция М.И.Коновалова) на примере 3-метилпентана:
- СН3 — СН2 – СН(СН3) – СН2СН3 + НО — NО2 → СН3–СН2 -С(СН3)(NО2)–СН2-СН3 +Н2О
3. Сульфирование:
- СН3 – СН2 – СН2 – СН3 +НО -SО3Н → СН 3– СН(SО3Н) – СН2 – СН3 + Н2 О
4. Реакции окисления:
- а) неполное окисление 2СН4 + 3О2 → 2СО + 4Н2О
- б) полное окисление СН4 + 2О2 → СО 2 + 2Н2О
5. Крекинг ( расщепление ) алканов:
- С4Н10 → С2Н6 + СН2 = СН2
6. Дегидрирование:
- СН3 – СН3 → СН2 = СН2 + Н2↑
Метан используется в основном в качестве дешевого топлива. При горении он дает почти бесцветное пламя. Из метана получают ценные химические продукты: метанол, синтез-газ, формальдегид, ацетилен, различные хлорпроизводные. Этан используется при синтезе этилена.
Пропан в смеси с бутаном используется в качестве топлива. Средние члены гомологического ряда используют как горючее для двигателей (бензин, керосин), а также в качестве растворителей.
Высшие алканы – топливо для дизельных двигателей, смазочные масла и сырье для производства моющих средств.
Алканы: строение и химические свойства, получение насыщенных углеводородов
Углеводороды представляют собой простейшие органические соединения. Их составляют углерод и водород. Соединения этих двух элементов называются предельными углеводородами или алканами. Их состав выражается общей для алканов формулой CnH2n+2, где n — количество атомов углерода.
Алканы — международное наименование данных соединений. Также эти соединения называют парафинами и насыщенными углеводородами. Связь в молекулах алканов простая (или одинарная). Остальные валентности насыщены атомами водорода. Все алканы насыщены водородом до предела, его атомы находятся в состоянии sp3-гибридизации .
Гомологический ряд предельных углеводородов
Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан — C2H6, пропан C3H8, бутан — C4H10.
С пятого алкана в гомологическом ряду названия соединений образуются следующим образом: греческое число, указывающее число атомов углеводорода в молекуле + окончание -ан. Так, по-гречески число 5 — пэндэ, соответственно за бутаном идет пентан — C5H12. Далее — гексан C6H14. гептан — C7H16, октан — C8H18, нонан — C9H20, декан — C10H22 и т. д.
Физические свойства алканов заметно изменяются в гомологическом ряду: увеличивается температура плавления, кипения, увеличивается плотность. Метан, этан, пропан, бутан при обычных условиях, т. е.
при температуре равной примерно 22 градуса тепла по Цельсию, являются газами, с пентана по гексадекан включительно — жидкостями, с гептадекана — твердыми веществами.
Начиная с бутана, у алканов есть изомеры. Существуют таблицы, отражающие изменения в гомологическом ряду алканов, которые наглядно отражают их физические свойства.
Номенклатура насыщенных углеводородов, их производные
Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана — этил, из пропана — пропил и т. д.
Радикалы также образуются и неорганическими соединениям. Например, отняв у азотной кислоты гидроксильную группу ОН, можно получить одновалентный радикал -NO2, который называется нитрогруппой.
При отрыве от молекулы алкана двух атомов водорода образуется двухвалентные радикалы, названия которых также образуются из названия соответствующих углеводородов, но окончание меняется на:
- илиен, в том случае, если атомы водорода оторваны от одного атома углерода,
- илен, в том случае, если от двух атомы водорода оторваны от двух соседних атомов углерода.
Алканы: химические свойства
Рассмотрим реакции, характерные для алканов. Всем алканам присущи общие химические свойства. Данные вещества являются малоактивными.
Все известные реакции с участием углеводородов подразделяются на два вида:
- разрыв связи С-Н (примером может служить реакция замещения),
- разрыв связи С-С (крекинг, образование отдельных частей).
Очень активны в момент образования радикалы. Сами по себе они существуют доли секунды. Радикалы легко вступают в реакции между собой. Их неспаренные электроны образуют новую ковалентную связь. Пример: CH3 + CH3 → C2H6
Радикалы легко вступают в реакции с молекулами органических веществ.
Они либо присоединяются к ним, либо отрывают от них атом с неспаренным электроном, в результате чего появляются новые радикалы, которые, в свою очередь, могут вступать в реакции с другими молекулами.
При такой цепной реакции получаются макромолекулы, которые перестают расти только тогда, когда оборвется цепь (пример: соединение двух радикалов)
Реакции свободных радикалов объясняют многие важные химические процессы, такие как:
- Взрывы,
- Окисления,
- Крекинг нефти,
- Полимеризацию непредельных соединений.
Подробно можно рассмотреть химические свойства насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации , и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Алканы могут гореть. Горит метан синеватым бледным пламенем. При этом результатом реакции будут оксид углерода и вода.
При смешивании с воздухом, а также в смеси с кислородом, особенно если соотношение объемов будет 1:2, данные углеводород образует взрывчатые смеси, из-за чего он крайне опасен для применения в быту и шахтах.
Если метан сгорает не полностью, то образуется сажа. В промышленности ее таким образом и получают.
Из метана получают формальдегид и метиловый спирт путем его окисления в присутствии катализаторов. Если же метан сильно нагреть, то он распадается по формуле CH4 → C + 2H2
Распад метана можно осуществить до промежуточного продукта в специально оборудованных печах. Промежуточным продуктом будет ацетилен. Формула реакции 2CH4 → C2H2 + 3H2. Выделение ацетилена из метана сокращает расходы производства почти в два раза.
Также из метана получают водород, производя конверсию метана с водяным паром. Характерными для метана являются реакции замещения.
Так, при обычной температуре, на свету галогены (Cl, Br) по стадиям вытесняют водород из молекулы метана. Таким образом образуются вещества, называемые галогенопроизводными.
Атомы хлора, замещая в молекуле углеводорода атомы водорода, образуют смесь разных соединений.
В такой смеси присутствуют хлорметан (CH3 Cl или хлористый метил), дихлорметан (CH2Cl2или хлористый метилен), трихлорметан (CHCl3 или хлороформ), тетрахлорметан (CCl4 или четыреххлористый углерод).
Любое из этих соединений может быть выделено из смеси. В производстве важное значение отводится хлороформу и тетрахлорметану, в силу того, что они являются растворителями органических соединений (жиров, смол, каучука). Галогенопроизводные метана образуются по цепному свободнорадикальному механизму.
Свет воздействует на молекулы хлора, вследствие чего они распадаются на неорганические радикалы, которые отрывают атом водорода с одним электроном от молекулы метана. При этом образуется HCl и метил. Метил реагирует с молекулой хлора, в результате чего получается галогенопроизводное и радикал хлора. Далее радикал хлора продолжает цепную реакцию.
При обычной температуре метан обладает достаточной стойкостью к щелочам, кислотам, многим окислителям. Исключение — азотная кислота. В реакции с ней образуется нитрометан и вода. Реакции присоединения для метана не характерны, т. к. все валентности в его молекуле насыщены.
Реакции, в которых участвуют углеводороды могут проходить не только с расщеплением связи С-Н , но и с разрывом связи С-С . Такие превращения происходят при наличии высоких температур и катализаторов. К таким реакциям относятся дегидрогенизация и крекинг.
Из насыщенных углеводородов путем окисления получают кислоты — уксусную (из бутана), жирные кислоты (из парафина).
Получение метана
В природе метан распространен достаточно широко. Он — главная составная часть большинства горючих природных и искусственных газов. Он выделяется из каменноугольных пластов в рудниках, со дна болот.
Природные газы (что очень заметно в попутных газах нефтяных месторождений) содержат не только метан, но и другие алканы. Применение этих веществ разнообразно.
Они используются как топливо, на различных производствах, в медицине и технике.
В условиях лаборатории данный газ выделяют при нагревании смеси ацетат натрия + гидроксид натрия, а также реакцией карбида алюминия и воды. Также метан получают из простых веществ. Для этого обязательными условиями являются нагрев и катализатор. Промышленное значение имеет получение метана синтезом на основе водяного пара.
Метан и его гомологи могут быть получены при прокаливании солей соответствующих органических кислот с щелочами. Еще одним способом получения алканов является реакция Вюрца, при которой нагреваются моногалогенопроизводные с металлическим натрием.