Большая часть известных химических элементов образует простые вещества металлы. К металлам относятся все элементы побочных (Б) подгрупп, а также элементы главных подгрупп, расположенные ниже диагонали «бериллий – астат». Кроме того, химические элементы металлы образуют группы лантаноидов и актиноидов.
По сравнению с атомами неметаллов, атомы металлов имеют большие размеры и меньшее число внешних электронов, обычно оно равно 1–2. Следовательно, внешние электроны атомов металлов слабо связаны с ядром, металлы их легко отдают, проявляя в химических реакциях восстановительные свойства.
- Расположение металлов в Периодической системе химических элементов и их свойства
- Изменение металлических и неметаллических свойств в таблице Менделеева
- Что такое металлические и неметаллические свойства
- Как изменяются металлические свойства в периодической системе
- Как изменяются неметаллические свойства в периодической системе
Расположение металлов в Периодической системе химических элементов и их свойства
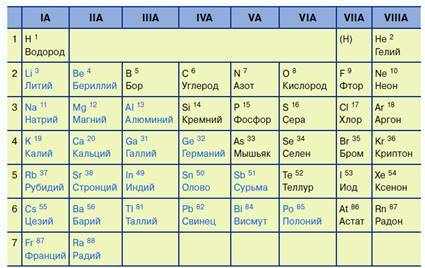
Расположение металлов среди элементов подгрупп А (выделены синим). Рассмотрим закономерности изменения некоторых свойств металлов в группах и периодах.
В периодах с увеличением заряда ядра радиус атомов уменьшается. Ядра атомов все сильнее притягивают внешние электроны, поэтому возрастает электроотрицательность атомов, металлические свойства уменьшаются.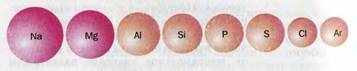
Изменение металлических свойств в периодах. В главных подгруппах сверху вниз в атомах металлов возрастает число электронных слоев, следовательно, увеличивается радиус атомов. Тогда внешние электроны будут слабее притягиваться к ядру, поэтому наблюдается уменьшение электроотрицательности атомов и увеличение металлических свойств.
Перечисленные закономерности характерны и для элементов побочных подгрупп, за редким исключением. Атомы элементов металлов склонны к отдаче электронов. В химических реакциях металлы проявляют себя только как восстановители, они отдают электроны и повышают свою степень окисления.
Принимать электроны от атомов металлов могут атомы, составляющие простые вещества неметаллы, а также атомы, входящие в состав сложных веществ, которые способны понизить свою степень окисления. Например:
- 2Na0 + S0 = Na+12S-2
- Zn0 + 2H+1Cl = Zn+2Cl2 + H02
Не все металлы обладают одинаковой химической активностью. Некоторые металлы при обычных условиях практически не вступают в химические реакции, их называют благородными металлами. К благородным металлам относятся: золото, серебро, платина, осмий, иридий, палладий, рутений, родий.
Благородные металлы очень мало распространены в природе и встречаются почти всегда в самородном состоянии. Несмотря на высокую устойчивость к коррозии-окислению, эти металлы все же образуют оксиды и другие химические соединения, например, всем известны соли хлориды и нитраты серебра.
Изменение металлических и неметаллических свойств в таблице Менделеева
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают.
Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов,
- натрия,
- калия,
- лития,
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои.
Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора.
Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
- фтор,
- кислород,
- азот,
- хлор,
- бром.
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов.
У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
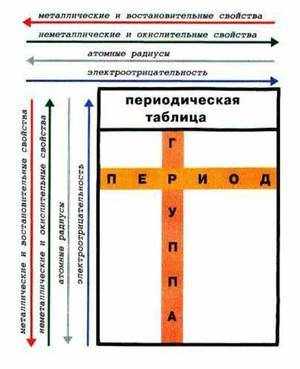
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать.
Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке. Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее.
Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же.
Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень. Неметаллические свойства уменьшаются в ряду сверху вниз (в группе).
Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк.
Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее.
Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.